Niveles energéticos
son la energía que tienen los electrones
alrededor del núcleo atómico, entre mas energía estarán mas lejos del núcleo,
las órbitas mas internas tienen menor energía potencial, para fugarse la partícula
del su núcleo, también se considera como una nube electrónica donde se mueve la
partícula que incluso tiene un giro, el giro del spin, lo encuentras todo con
sus niveles energéticos en las tablas cuánticas REEMPE( Región Espacio Energética
de Manifestación Probabilística Electrónica) en la tabla periódica normal
tienes letras en los niveles que supuestamente tiene cada átomo y te dicen
cuantos electrones hay en cada nivel orbital.




Subniveles energéticos
Los
subniveles energéticos se designan como s, p, d, y f estas
letras son tomadas de las palabras empleadas para dar
nombres a las líneas de las series espectrales
del hidrógeno así: s de Sharp, p de principal, d de difude y
f de fundamental. Cada uno de los corresponde a las diferentes valores
de l y puede contener un numero determinado de electrones. Por ejemplo
cuando 1=0, le corresponde el subniveles s, que puede contener
un máximo de electrones si l=1 le corresponde el
subnivel p, que puede contener máximo de
6 electrones.
Se indicara
el subnivel que corresponde a cada valor de
l, así como el número máximo de electrones que
soporta:
Valore del numero cuántico secundario
l
|
Tipo de subniveles
|
Numero máximo de electrones
|
0
|
s
|
2
|
1
|
p
|
6
|
2
|
d
|
10
|
3
|
f
|
14
|

Orbital atómico
Un orbital atómico, se puede decir que es una zona del
espacio donde hay una gran probabilidad, casi mayor del 90%, de encontrar al
electrón, lo que supone poder considerar al electrón o electrones, como una
nube indefinida cargada que gira entorno al núcleo, donde hay mayor densidad en
las zonas donde la probabilidad de encontrar al electrón, es mayor.

Estos tres números cuánticos hacen referencia a la energía total del electrón, el momento angular orbital y la proyección del mismo sobre el eje z del sistema del laboratorio y se denotan por

Relación entre la tabla periódica y la configuración
Electrónica

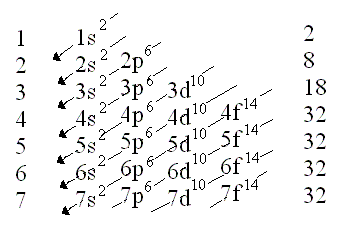
Al referirnos a la configuración electrónica (o periódica) estamos hablando de la descripción de la ubicación de los electrones en los distintos niveles (con subniveles y orbitales) de un determinado átomo.
o modelo de la mecánica cuántica. En esta representación se indican los niveles, subniveles y los orbitales que ocupan los electrones.
Debemos acotar que aunque el modelo de Schrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
Historia de la tabla periódica
Científico
Jeremías Benjamín Richter (1762-1807)
|
Aporte
Escribe su libro principios de Estequiometria
entre 1792 y 1793, en él explica los pesos de combinación también llamados
pesos equivalentes de los elementos químicos. Es el creador de la Estequiometria.
Richter encontró relaciones regulares entre los pesos de combinación de ciertos elementos por lo que los ordenó en una serie numérica, naciendo así un primer ensayo de un sistema periódico de los elementos. |
Johann Wolfgang Dobereiner
|
Después de RICHTER, en 1829 aparece Johann
Walfang Dobereiner quien observa que ciertos elementos que tenían propiedades
muy semejante , mostraban cierta regularidad en sus masas atómicas , de tal
manera que los ordeno en grupos de tres elementos , en orden creciente de sus
pesos atómicos, encontrando que el de en medio tenía como peso atómico , un
peso igual a la mitad de la suma del primero y el tercero y a la vez que la
diferencia entre los tres era una cantidad constante o casi constante , los
ej.: Litio Ma 7 , sodio Ma23 potasio Ma 39 d, diferencia entre sus masa 16 ,
igual con el Ca, Sr y Ba.
|
John Alexander Reina Newlandas.
La tabla de mendeleef en 1913
Henry Gwynn – Jeffreys Moseley (1913)
|
Después de Dobereiner, casi 40 años después
aparece el inglés John Alexander Reina Newlands que el 20 de agosto de 1864
presenta un ordenamiento de los elementos al cual le llamo Ley de Octavas.
Newlands observó que al disponer los elementos de acuerdo a sus masas atómicas , y sin tener en cuenta el hidrógeno Las propiedades después de cada séptimo se repetían , eran muy semejantes . Tablas de Lotar meyer y Dumitry Ivanovich Mendeleeff Ambos por separado presentaron tablas periódicas muy semejantes, Lotar meyer en Alemania en diciembre de 1869 y la de mendeleeff en Rusia en agosto del mismo año. Mendeleeff publico su ordenamiento de los elementos de acuerdo a sus pesos atómicos en ocho columnas, dejando espacios en blanco de elementos no descubiertos, (ya que en ese tiempo se conocían una poco más de 50 elementos).
Se modificó en el ordenamiento de algunos
Elementos cuando HENRY G. J. MOSELY ordenó los elementos de acuerdo a sus
números atómicos, eliminando las dificultades que presentaba la tabla DE
mendeleeff o sea la inversión de los pesos atómicos del teluro y el yodo, el
potasio y el argón.
Después GLENNT Seaborg (1912-1999) Modifico la tabla periódica colocando los actínidos y los lantánidos fuera de la tabla, abajo.
Bombardearon diferentes
elementos con electrones de alta energía y observaron que la frecuencia de
los rayos X que se generaban, variaba con regularidad al pasar de un elemento
a su vecino inmediato, por lo que acomodaron estas frecuencias en orden,
asignado a cada elemento un valor entero único al cual llamaron “número
atómico”.
|
No hay comentarios:
Publicar un comentario